Entropie Definition
Entropie – das Maß für die Unordnung. In Wirklichkeit steckt aber noch viel mehr dahinter und das wollen wir uns hier genauer anschauen.
Inhaltsübersicht
Entropie bei reversiblen Prozessen
Zunächst einmal schauen wir uns noch einmal die beiden verschiedenen Arten von Prozessen an. Wir unterscheiden zwischen reversiblen und irreversiblen Prozessen.
Ein reversibler Prozess ist ein Prozess, der sich derart umkehren lässt, dass der Ausgangszustand wieder erreicht erden kann, ohne dass dabei Änderungen in der Natur oder Umgebung zurückbleiben.
Mit anderen Worten: Eine thermodynamische Zustandsänderung, die in beide Richtungen ablaufen kann, ohne dass dabei Veränderungen am Köper selbst oder an der Umgebung vorgenommen werden
Lassen wir beispielsweise einen prall gefüllten Basketball fallen, dann ist der Zustand annähernd reversibel, weil der Basketball nach dem Aufprall beinahe wieder seinen Ausgangszustand erreicht. Ähnlich ist es bei einem Fadenpendel.
Entropie bei irreversiblen Prozessen
Bei einem irreversiblen Prozess hingegen kann das System ohne zusätzliche Krafteinwirkung von außen nicht wieder in seinen Ausgangszustand zurückkehren. Das wäre zum Beispiel der Fall, wenn wir anstelle unseres Basketballs einen Ball aus Knete fallen lassen. Dieser verformt sich beim Aufprall und bleibt auf dem Boden liegen.
Reale irreversible Prozesse mit Energiedissipation führen zu einer Entropieproduktion im Inneren des Systems. Dann gilt:

Die sogenannte Entropieerzeugungsrate ist also immer positiv.
Bei idealen reversiblen Prozessen ist die Entropieerzeugungsrate Null und folglich

Studyflix vernetzt: Hier ein Video aus einem anderen Bereich
Entropieänderung
Die Entropieänderung ΔS beschreibt die Entropie während eines Prozesses.

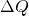 ist dabei die irreversibel umgesetzte Wärmemenge und T die absolute Temperatur, bei der der Prozess abläuft.
ist dabei die irreversibel umgesetzte Wärmemenge und T die absolute Temperatur, bei der der Prozess abläuft.
In der Realität der Thermodynamik sind jene Zustandsänderungen nicht umkehrbar beziehungsweise irreversibel, die sich auf einen Gleichgewichtszustand hinbewegen; jenen Zustand also, bei dem keine Temperatur- oder Druckunterschiede mehr vorliegen und aus dem sich das System mangels Potentialunterschieden nicht mehr herausbewegt.
Ein klassisches Beispiel hierfür ist ein Getränk mit Eiswürfeln im Sommer. Das Eis im Glas schmilzt und kühlt unser Getränk ab. Es findet ein Wärme- beziehungsweise Energieaustausch zwischen dem Eis und unserem Getränk statt bis alles die gleiche Temperatur hat. Dieser Vorgang läuft ganz von allein ab. Unter keinen Umständen jedoch wird sich unser gekühlter Drink nun von allein wieder in ein warmes Getränk und einen Eiswürfel verwandeln. Daher ist der Vorgang irreversibel.
Zur Erinnerung: Dieses Phänomen beruht auf dem 2. Hauptsatz der Thermodynamik , der besagt, dass Wärmeenergie immer vom Warmen zum Kalten fließt, jedoch nie umgekehrt.
Somit sind viele thermodynamische Prozesse irreversibel. Als Maß für die Irreversibilität wurde die Entropie eingeführt.
Entropie – Maß der Unordnung
Jetzt hast du verstanden, wie die Entropie definiert ist. Doch warum wird die Entropie oft als Maß der Unordnung bezeichnet?
Wir erinnern uns kurz an den 3. Hauptsatz der Thermodynamik . Dieser besagt nämlich, dass am absoluten Nullpunkt, also bei T = 0 Kelvin die Entropie S ebenfalls 0 Joule pro Kelvin beträgt. Mit der Temperatur steigt dann auch die Entropie bei jedem irreversiblen Prozess.
Wie du siehst steckt hinter der Entropie tatsächlich noch viel mehr als nur ein Maß für die Unordnung. Viel Spaß und bis bald.


